(1)一酸化窒素合成酵素の細胞内タンパク質との相互作用による活性制御機構
Regulation of nitric oxide synthase by interaction with cellular
proteins.
ガス状のラジカル分子である一酸化窒素NOは、生体内で神経伝達、記憶や血圧調節などにおいて情報伝達物質として重要な役割をはたし
ている。一方過剰に生成すると、NOは細胞障害のメディエーターとして炎症や虚血など種々の病態に関与する。このようなNOの細胞毒性は、細胞内の活性酸
素分子種と反応してスーパーオキシナイトライト(ONOO-)などの種々の活性NO分子種(RNS) ができることと関連している。これらのRNS
は、DNA損傷やカスパーゼなどのタンパク質のシステインのチオールのニトロソ化、又SODなどのチロシンのニトロ化などを引き起こしアポトーシスを制御
することが分かってきた。したがって、このNO分子の二面的な生理作用を理解するためには、生体内でNOの生成がどのように制御されているかを明らかにす
ることが必要である。
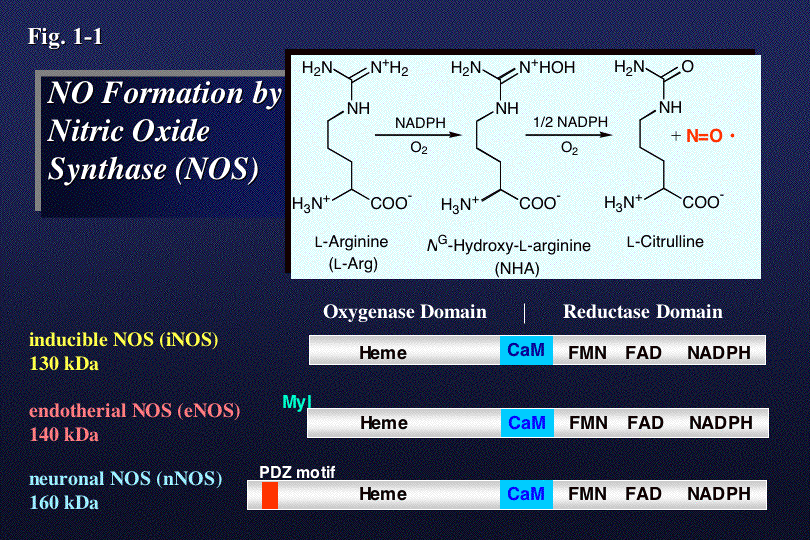
NOは、生体内で一酸化窒素合成酵素(NOS)によってアルギニン(L-Arg)から二段階の酸化反応を経て合成される(Fig.1-1)。NOSは、テ
トラ
ヒドロビオプテリンH4Bを必須補因子とし、ヘムやH4B、基質結合部位を含むオキシゲナーゼドメインと、NADPH、FAD、FMN
結合部位をふくむ還元酵素ドメインからなる。その両ドメイン間にあるカルモデュリン(CaM)結合部位にCaMが結合することによって電子移動が促進さ
れ、NO合成活性が発現する。私達は、遺伝子工学的手法により作成した各種変異酵素を用いて、この酵素による酸素の活性化、基質選択性、及び電子伝達など
の触媒反応に重要な化学反応を解析し、活性部位の構造と活性制御機能の関係を明らかにしようと研究を行っている。
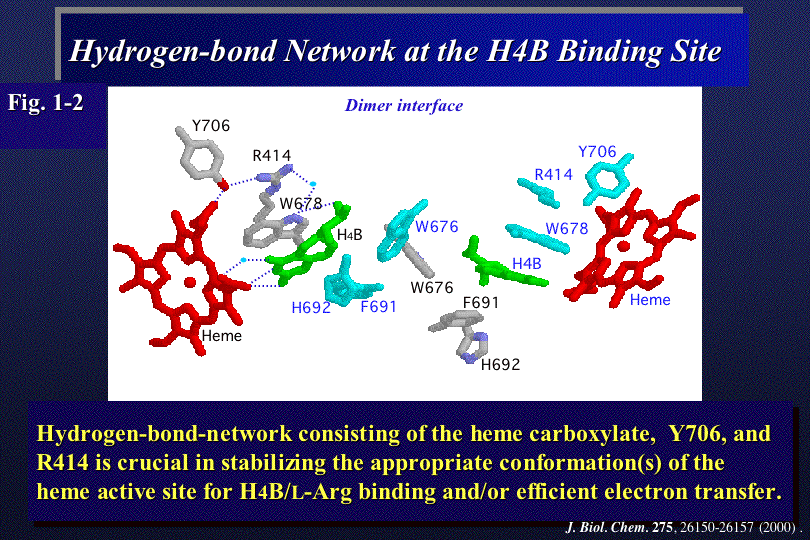
NOSの反応には、補因子テトラヒドロビオプテリンH4Bが必須であり、NOSはダイマーのときのみ活性型である。種々のアミノ酸の変異体を解析し
た結果、H4B結合部位の芳香族アミノ酸およびヘムを囲む分子内水素結合ネットワークがH4Bの結合と反応活性に必須の電子移動に重要であることが示唆さ
れた(Fig.1-2)。
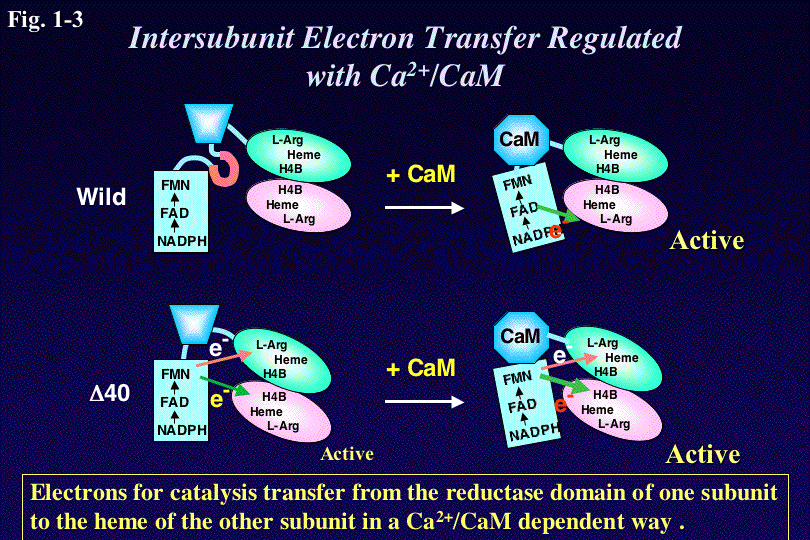
さらに私達は、完全長のnNOSとオキシゲナーゼドメインサブユニット
からなる各種ヘテロダイマーの解析から、nNOS野生型においては、活性に必要な電子は、二量体の一方の還元酵素ドメインから別のサブユニットのヘムドメ
インへ分子間で伝達されることを明らかにした。またCaMが結合することによって蛋白の高次構造が変わり、それによってはじめてこの分子間電子移動が可能
になることを示した(Fig.
1-3)。またnNOSの還元酵素ドメインにある40個のアミノ酸を欠損させたところ、その欠損変異体△40はCaM依存性がな
くなりCaMが存在しなくてもNO合成能とヘムへの電子伝達能を示した。このことから、この40アミノ酸は、活性自己阻害配列として働き、生体内でカルシ
ウム濃度が低い時にNO合成活性を制御する役割を果たすことがわかった。
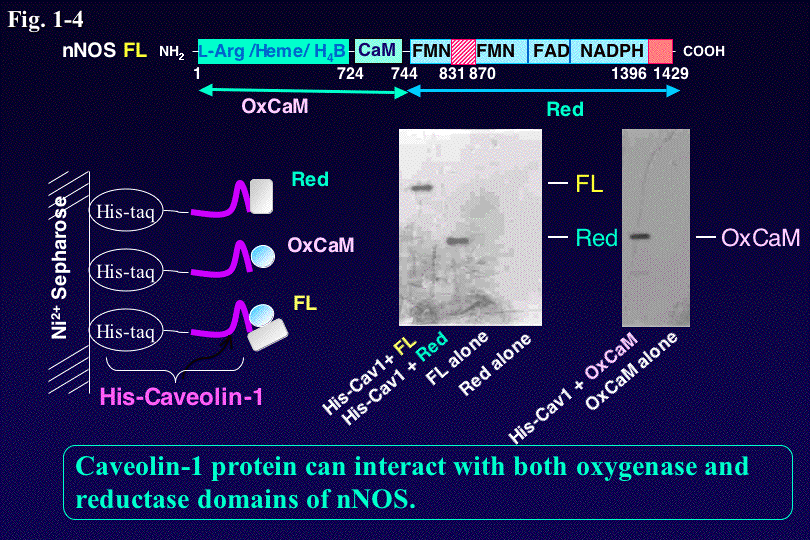
このようなCa2+/CaMや自己阻害配列による制御以外にも、NOSはリン酸化によっても活性制御される。また、NOSと他の細胞内蛋白質と相互
作用によってNO合成反応の阻害、活性化、NOSの細胞内局在化や寿命などが調節されることが分かって来た。例えば、 nNOSは、
N端にあるPDZドメインを介してPSD-95、PSD-93,
a1-Syntrophinなどと相互作用することが知られている。またnNOSはCaveolin、PINやCAPONなどの結合によって阻害を受け
る。私達は、CaM
によるnNOSの活性化とCaveolinによる阻害を解析することによって、NOSとCaveolinとの相互作用部位の特定と阻害の分子メカニズムを
明らかにした(Fig.
1-4)。さらに今後は、リン酸化や蛋白ー蛋白相互作用を介した他の情報伝達カスケードとのクロストーク機構やNOSの細胞内寿命など、細胞内でのNOS
活性のダイナミックな制御機構の解明を目指している。
References
- Sato, Y., Sagami, I., and Shimizu, T. " Identification of
caveolin-1-interacting sites in neuronal nitric oxide synthase:
molecular mechanism for inhibition of NO formation." (2004) J.
Biol. Chem. 279, 8827-8836
- Rozhkova, E., Fujimoto, N., Sagami I., Daff S., and Shimizu
T.,
“Interactions between the Isolated Oxygenace and Reductase Domains of
Neuronal Nitric Oxide Synthase: : Assessing the Role of Calmodulin”
(2002) J. Biol. Chem. 277, 16888-16894
- Sagami, I., Daff, S. N., and Shimizu, T. “Intrasubunit and
Intersubunit Electron Transfer in Neuronal Nitric-oxide Synthase:Effect
of Calmodulin on Heterodimer Catalysis” (2001) J. Biol. Chem.
276, 30036-30042.
- Daff, S. N., Sagami, I., and Shimizu, T. “The 42-Amino Acid
Insert in the FMN Domain of Neuronal Nitric-oxide Synthase Exerts
Control over Ca2+/Calmodulin-dependent Electron Transfer” (1999) J.
Biol. Chem. 274, 30589-30595
- Sagami, I., and Shimizu, T. “The Crucial Roles of Asp314
and Thr315 in the Catalytic Activation of Molecular Oxygen by Neuronal
Nitric Oxide Synthase: A Site-directed Matagenesis Study”
(1998) J. Biol. Chem. 273, 2105-2108.
- 佐上郁子、佐藤裕子、清水透、「NO合成酵素の構造と機能:主に電子伝達のメカニズムについて」 (2003) 生化学 75,
pp351-358
(2)生物時計の転写レベルでのCOによる制
御機構の解析とシグナル伝達
Regulation of circadian rhythm by a CO-responsive transcription factor.
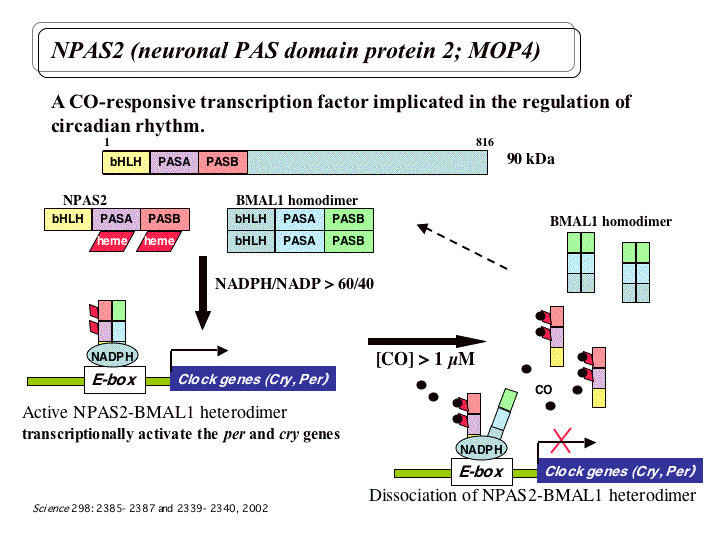
哺乳類の概日リズムの本体は、脳の視交叉上核での光のシグナルに応じた転写因子BMAL1/CLOCKヘテロダイマーによる時計遺伝
子の転写促進とその産物による転写抑制からなるフィードバックループであると考えられている。 さらに、前脳ではCLOCK類似体NPAS2が発現し、
NADPH存在下でBMAL1とヘテロダイマーを形成して時計遺伝子の発現を制御すること、NPAS2欠損マウスは夜間に異常な睡眠パターンを示し摂食ス
ケジュールの変化に順応できないということがわかってきた。こうした結果は、CLOCKが光による体内時計の制御に関わり、NPAS2が摂食やホルモンな
どによって制御されるリズムに関わる、というモデルを示唆するが、そのメカニズムの全容は明らかになっていない。また最近、NPAS2はヘムを結合してお
り、ヘムへのCOの結合によって活性が制御されることが報告された。そこで本研究では、特にNPAS2の部位特異的あるいは機能ドメインのみの変異体作成
を行い、ヘムやNADPH結合様式とガス小分子の効果や活性を解析する。それによって摂食や
CO、低酸素などの環境因子による時計遺伝子の制御機構を分子レベルで明らかにする。
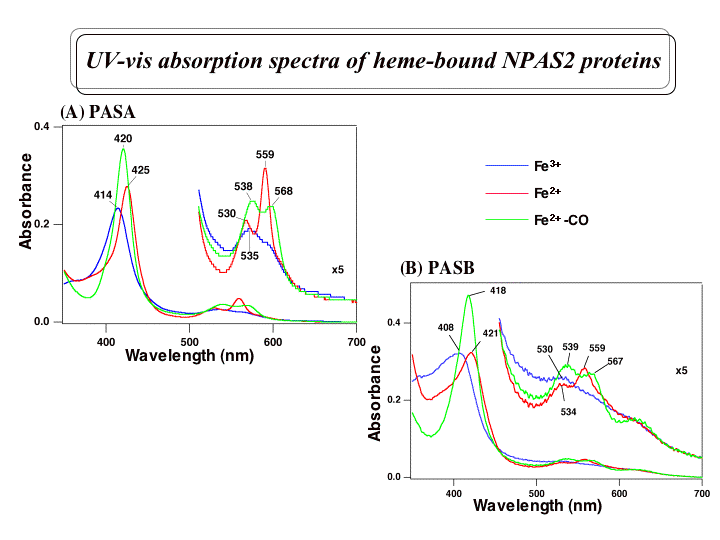
これまで私達は、マウス脳のRNAよりRT-PCR法を用いてマウスNPAS2のcDNAをクローニングし、大腸菌での発現系を構築した。PAS
Aドメインの発現では、ヘムの結合しないアポタンパク質として精製された。精製したPAS Aドメインとヘムとの再構築を行い解析したところ、PAS
Aタンパク質1モルあたり1モルのヘムが結合し、そのFe
(III)錯体は典型的な6配位低スピン型の可視吸収スペクトルを示すことがわかった。また、SDS-PAGEとゲルろ過の結果から、アポタンパク質もヘ
ム結合型PAS
Aも溶液中では二量体であることがわかった。さらに、ヘムの内部配位子を同定するために変異体を作成し解析中である。また、CO結合によるシグナルが、ど
のようにNPAS2の構造変化を誘起し、機能の変化へと伝達されるかを明らかにするために研究を行っている。
Reference
- Dioum EM, Rutter J, Tuckerman JR, Gonzalez G, Gilles-Gonzalez MA,
McKnight SL. “NPAS2: a gas-responsive transcription factor.” (2002)
Science. 298, 2385-7.





